
באדיבות astropedia
בכל פעם שחומרים בעלי טמפרטורה שונה נמצאים במגע, החום יזרום מחומר אחד למשנהו. זרוק קובית קרח לכוס מים והקרח יתחמם וימס בזמן שהמים מתקררים. יוצקים מים רותחים מקומקום לאמבט פושר והמים הרותחים מתקררים בעוד המים שבאמבטיה מתחמים. הדבר נכון לגבי כל שני חומרים. גע במכונית החשופה לשמש החמה והחום יזרום מהמתכת לאצבעך. ניתן לחשוב מה קורה כאשר אודיטוריום מתמלא באנשים. טמפרטורת הגוף גבוהה יותר מטמפרטורת החדר, ולכן בני האדם מקרינים חום. החום זורם מהאנשים לאוויר שבחדר, והחדר מתחמם.
הניסיון היומיומי שלנו מראה שהחום נוטה לזרום מחומר חם לחומר קר יותר. המחקר העוסק במעברי החום נקרא תרמודינמיקה. חלק מן הניסויים הראשונים בנושא זה נעשו על ידי אייזיק ניוטון, שמצא כי קצב העברת החום בין שני גופים או אזורים סמוכים נמצא ביחס להפרש הטמפרטורות ביניהם. אם אין הבדל בין טמפרטורה של הגוף לסביבתו, לא תהיה זרימת חום. אבל ככל שההבדל גדול יותר בין הטמפרטורות, מעבר החום מהאזור החם לאזור הקר יגדל. באמצעות הצורה המתמטית של חוק זה, ניוטון חישב כמה זמן נדרש לגופים חמים להתקרר מטמפרטורה נתונה לטמפרטורת הסביבה.
הדוגמאות היומיומיות הללו ממחישות את מושג שיווי המשקל. כאשר קיימים במערכת אזורים בעלי טמפרטורות שונות, יזרום חום במערכת עד שהיא תגיע לשיווי משקל. מצב שבו כל האזורים נמצאים באותה טמפרטורה, כך שלא זורמת אנרגית חום, מעיד שהמערכת נמצאת בשיווי משקל. כאשר קוביית הקרח נמסה, אנרגיית החום זורמת מהמים בכוס אל הקרח. לאחר שקוביית הקרח נמסה, המים בכוס נמצאים באותה טמפרטורה, נמוכה יותר בהשוואה למצב טרם הכנסת הקרח. כאשר אתה שופך מים רותחים לתוך אמבט, החום זורם אל המים באמבטיה. לאחר ערבוב המים הרותחים, למים באמבט אותה טמפרטורה, הם חמים יותר מאשר קודם ליציקת המים הרותחים. התוצאה הסופית של שתי הפעולות היא מצב שיווי משקל.

באדיבות pixabay
עיקרון זה של שיווי משקל פועל הן ברמה המיקרוסקופית והן ברמה המקרוסקופית. טמפרטורה היא רק מידה של קצב תנועת האטומים או מולקולות בגוף. החלקיקים הזעירים בתוך מתכת חמה מאוד נעים במהירות רבה יותר מאשר החלקיקים בעור היד. כאשר אתה נוגע מתכת החמה, החלקיקים המהירים במתכת פוגעים בחלקיקים בעור היד וגורמים להם לנוע מהר יותר. חום מועבר אל האצבע שלך המתחממת. המולקולות בקוביית קרח רוטטות לאט יותר מהמולקולות במים. כאשר הקרח נמס, המולקולות במים הסמוכים לקובית הקרח מאטים והמים מתקררים.
ניתן לתאר את המושג של זרימת החום אם נדמיין קבוצת כדורים המונחת על שולחן ביליארד. בואו נדמיין שהם מייצגים אטומים. נניח שהם אינם נעים, בדומה לאטומים הנמצאים בטמפרטורה של האפס המוחלט, או אטומים חסרי חום. עכשיו נגלגל כדור לבן במהירות על השולחן, כך שהוא פוגע בעוצמה בכדורים הנחים. כדור זה מייצג אטום "הנכנס למערכת" במהירות גבוהה ולכן הוא בעל טמפרטורה גבוהה. הכדור הלבן המתנגש בכדורים הנייחים, והם מתחילים לנוע בעוד שהכדור הלבן מאט. הכדור הלבן מעביר אנרגיה לשאר הכדורים. כתוצאה מכך, הכדור הלבן "מתקרר" והכדורים האחרים "מתחממים". הדבר דומה למעבר החום כאשר טיפה של מים רותחים נופלת לתוך נוזל קריר.
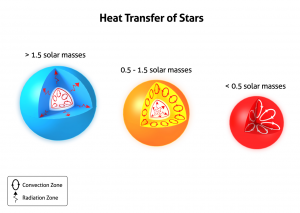
באדיבות astropedia
אטומים חמים או מולקולות חמות נעות מהר יותר בהשוואה למולקולות קרות. אם יש לנו גוף חם הנמצא בסמוך לגוף קר יותר, אז תזרום אנרגיה מהגוף החם לגוף הקר. האנרגיה הקינטית הממוצעת של מולקולות בגוף החם תרד והאנרגיה הקינטית הממוצעת של המולקולות בגוף הקר תגדל. כאשר האנרגיה הקינטית הממוצעת למולקולה זהה בשני הגופים – כלומר כאשר הם מגיעים לאותה טמפרטורה – הם נמצאים במצב של שיווי משקל ולא תהיה עוד זרימת חום ביניהם. הטבע מציג נטייה כוללת לנוע לעבר מצבי שיווי המשקל.
הרעיונות של העברת חום ושל מצבי שיווי משקל חוזרים שוב ושוב במחקר של כוכבי לכת וכוכבים. שיווי המשקל הוא עקרון פיזיקאלי כללי למדי, ולכן כאשר אנו מתמודדים עם מצב של זרימת חום אנו עוסקים בהתקרבות למצב של שיווי משקל תרמי. במילים פשוטות, משמעות הדבר היא כי גופים בעלי טמפרטורות שונות הנמצאים במגע נוטים להשוות את הטמפרטורות שלהם.
Author: Chris Impey

