בואו ננסה את הטריק הבא. ממלאים כוס עם מים עד שוליים ומניחים כרטיס משחק חלק מעל. החזק את הכרטיס במקום בעזרת האצבע והפוך את הכוס. עכשיו הסיר את האצבע. הכרטיס לא זז והמים נשארים בכוס! הטריק עובד משום שהאוויר מפעיל לחץ המתמודד עם משקל המים; זה לא יעבוד על הירח שבו אין לחץ אטמוספרי. מדענים הבינו במאה ה- 17 שאנו חיים בתחית ים של אוויר. לחץ הוא אחד המאפיינים של האוויר או של כל גז אחר.

באדיבות וויקיפדיה
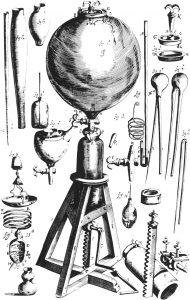
אוטו פון גריקה היה ראש העיר הגרמנית של מגדבורג ומדען חובב מוכשר. הוא המציא משאבת ואקום והראה כי נוצות ואבנים נופלים באותו קצב בהיעדר התנגדות אוויר – תוצאה ניסויית המאשרת את תחזיתו של גלילאו. הוא גם הראה כי האוויר הוא חיוני לחיים על ידי שאיבת האוויר מתוך צנצנת המכילה בעלי חיים קטנים. פון גריקה הדגים את העוצמה של לחץ אוויר בניסוי מרהיב. הוא בנה כדור נחושת בקוטר חצי מטר המורכב משני חצאי כדור. לאחר ששאב את האוויר מן הכדור בעזרת משאבה, שתי קבוצות של שמונה סוסים לא יכלו למשוך להפריד את שני החצאים. אבל כשפתח את השסתום והחזיר את האוויר פנימה, נפרדו החצאים ללא כל מאמץ.
אנו מגדירים את הלחץ ככוח הפועל על שטח. מתמטית, P = F / A. כלומר אם אותו כוח הפועל על שטח קטן הוא גורם ללחץ גבוה יותר. חלוקת כוח (או משקל) על שטח גדול יותר היא הסיבה שאתה עלול לשקוע לתוך שלג כאשר נועל נעליים אבל לא כאשר נועל מגלשים. זה גם מסביר למה אפשר לשכב בבטחה על המיטה עשויה מסמרים מאשר לשבת על מסמר אחד שעלול לחדור את העור. לחץ האוויר מופעל על חלון גדול בבית מגורים שווה בערך עשר פעמים המשקל שלך! באותו זמן, האוויר בפנים מפעיל לחץ שווה החוצה כך ששני הכוחות מאוזנים.
באדיבות וויקיפדיה
המחקר השיטתי הראשון של תכונות הגזים בוצע על ידי רוברט בויל באמצע המאה ה- 17, כאשר ניוטון היה עדיין בחיים. בויל היה הצעיר מבין ארבעה-עשר ילדים של הרוזן מקורק, אחד האנשים העשירים ביותר באירלנד. בויל הפעיל כוח על כמות קבועה של אוויר, שהיה הגז היחיד שהיה ידוע באותה עת, ומדד את הלחץ. בתנאים של טמפרטורה קבועה, הוא הבחין ביחס הפוך פשוט בין לחץ ונפח
P α 1 / V
אם נגדיל את הלחץ על הגז, נפחו יקטן. אתה יכול לראות את זה בקלות במשאבת אופניים. אם אתה מכסה את השסתום ולוחץ על הבוכנה, נפח עמודת האוויר במשאבה קטן. בויל סיכם כי "יש כוח קפיץ או אלסטי לאוויר שאנו חיים בו" ואתה יכול להרגיש אותו גם כאשר אתה לוחץ מעלה ומטה על משאבה. כאשר אתה מפעיל כוח גדול יותר גדל הלחץ, והאוויר נדחס עוד יותר.
בסוף המאה ה- 18, כמה מדענים צרפתים ביצוע גילוי חשוב על גזים. אם הגז מחומם (והלחץ קבוע), הוא מתרחב ב- 0.3% מהנפח שלו בכל מעלת צלזיוס שהוא מחומם. אם נשתמש בסולם טמפרטורת קלווין, יתקיים הקשר הפשוט
V α T
הגז מתרחב ככל שהוא מתחמם. הכפלת הטמפרטורה של כמות גז נתונה והנפח שלה יוכפל. אתה יכול לראות את ההתנהגות הזאת גם במשאבת אופניים. לחץ חזק ככל האפשר על הבוכנה והחזק אותה. לאחר דקה בערך, צינור המשאבה יהיה חם יותר. ניתן לחשוף קשרים בין גדלים פיזיקליים התקפים עבור כל גז. בעזרת שילוב שני היחסים ליניאריים עבור גז, בין לחץ ונפח בין נפח וטמפרטורה, נקבל
P V α T
משוואה זו היא כלי רב עוצמה להבנה וחיזוי התנהגות גזים. המשוואה נקראת לעתים קרובות את חוק הגז האידיאלי. קיימות כאן מספר הנחות לגבי המולקולות המרכיבות גז. ההנחות הן: (1) מספר המולקולות גדול מאוד, (2) המולקולות תופסות חלק זעום של נפח הגז, (3) המולקולות נמצאות בתנועה אקראית מתמדת; (4) אין כוחות בין המולקולות, ו- (5) המולקולות מתנגשות האחת בשנייה מבלי לאבד אנרגיה. במצב נורמלי בכדור הארץ, הנחות אלו תקפות.
חוק הגז האידיאלי מתאר את הטמפרטורת והשינויים בצפיפות של האטמוספירה של כדור הארץ כתלות בגובה. הוא מתאר גם את השינויים של טמפרטורה וצפיפות של כל האטמוספרות הפלנטריות. בהמשך ניתן לחזות את התנאים שבהם גז יכול להיות להידחס ולהפוך לנוזל או מוצק. המבנה המיוחד של האטמוספירה הענקית של כוכב הלכת הוא ביטוי של חוק פיזיקלי שנבחן היטב.
מאפייני הגז הכלליים כמו לחץ וטמפרטורה קשורים למאפיינים המיקרוסקופיים של אטומים ומולקולות. דניאל ברנולי היה הראשון שהגיע לתובנה הזאת, באמצע המאה ה- 18. ברנולי היה ראש משפחה יוצאת דופן – לא פחות משמונה מבניו ונכדיו הפכו למדענים ולמתמטיקאים! ברנולי הבין כי לחץ הגז נגרם על ידי התנגשויות מיקרוסקופיות מתמשכות של מולקולות גז עם מיכל שלהם. דחיסת הגז מגדילה את מספר ההתנגשויות בכל שנייה, ומכאן הלחץ. דחיסת גז גם מגביר את האנרגיה של כל התנגשות, ומכאן עליית הטמפרטורה. חישוביו של ברנולי הראו שמכפלת הלחץ בנפח נמצאת ביחס ישר למספר המולקולות (N) והאנרגיה הקינטית הממוצעת של כל אחת מהן
P V = 2/3 N (1/2 mv2)
האנרגיה הקינטית של חלקיק קשורה לטמפרטורה שלו 1/2mv2 = 3/2 kT הצבת קשר זה במשוואה לעיל, נקבל
P V = N k T
כאשר קבוע בולצמן (k) ומספר המולקולות (N). חוק קטן אלגנטי זה חל על כל הגז ומתקיים בתנאים הפיזיים השונים בכל פלנטה.

