היוונים הקדמונים חשבו על אטומים כעל חלקיקי חומר, כמו חרוזים זעירים. אפילו דלטון העלה בדעתו שאטומים הם כדורים קטנים וקשים. עם זאת, בסביבות 1900, ג'.ג' תומסון גילה חלקיקים הנקראים אלקטרונים. לאלקטרון יש מטען חשמלי שלילי, והוא קל בהרבה מהאטום הקל ביותר. תומסון הוכיח לאטום יש מבנה וכי האטומים הם לא אבני היסוד הקטנות ביותר של החומר. הבמה נערכה להופעתו של ארנסט רתרפורד.
באדיבות וויקיפדיה
במסגרת עבודתו באוניברסיטת קיימברידג ', ערך ארנסט רתרפורד, פיזיקאי יליד ניו-זילנד, ניסוי שנועד לחדור דרך האטום. התוצאות הראו כי לאטומים יש מבנה והם אינם כדורים זעירים קשים. לצורך הניוסי השתמש רתרפורד בקלעים זעירים שנקראו חלקיקי אלפא. חלקיקי אלפא נפלטים במהירות גבוהה מחומרים רדיואקטיביים מסוימים. יש להם מטען חשמלי חיובי והם הרבה יותר מסיבים מהאלקטרון. יהמסה שלהם שווה למסת אטום ההליום. ראתרפורד הפציץ רדיד הזהב בחלקיקי אלפא וראה שלושה דברים. רוב חלקיקי האלפא עברו ישר דרך הרדיד כאילו לא היה שם. חלק קטן מחלקיקי האלפא חלף, אך הוסט בזוויות קטנות. חלק קטן יותר נרתע לאחור, כלומר הפוכו את כיוון התנועתם. רתרפורד השתמש בתוצאות אלו כדי להסיק מהו המבנה הבלתי נראה של האטום. המסקנה הראשונה של רתרפורד הייתה שאטומים אינם כדורים זעירים. מפני שמרבית חלקיקי אלפא עברו דרך רדיד הזהב, האטום חייב להיות מורכב בעיקר מנפח ריק. ההסטיות הקטנות של חלקיקי אלפא פרושו ע"י רותרפורד כעדות שמרכז האטום הוא בעל מטען חשמלי חיובי. זהו הגרעין האטומי. הוא הבין את זה כי ניתן להסביר סטיות אלה על ידי חלקיקי אלפא טעונים במטען חיובי טס לעבר מרכז האטום ונדחה על ידי גרעין טעון חיובית. ההסטיות נגרמו על ידי כוח חשמלי מוכר. התוצאה השלישית – מיעוט של חלקיקי אלפא נרתעו לאחור, רותרפורד פרש זאת כהתנגשות מצח עם הגרעין המכיל כמעט את כל המסה של האטום .
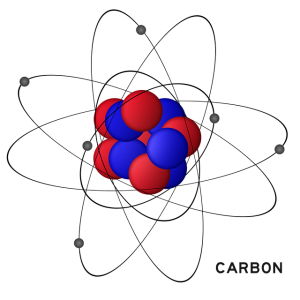
לאחר עבודתו של רתרפורד, צצה תמונה מוכרת של האטום. הגרעין האטומי, הצפוף והקטן, מוקף באלקטרונים. תמונה זו של האטום כמערכת סולארית זעירה הפכה לסמל לעידן המדעי המודרני שלנו. עם זאת, האנלוגיה עם מסלולי הכבידה פגומה. לרותרפורד לא היה הסבר מדוע האלקטרונים צריכים להישאר במסלולם. למעשה, שיקול פשוט של הכוח החשמלי מראה כי אטומים עשויים גרעינים טעונים חיובי ושאלקטרונים הטעונים במטען שלילי אינם יציבים. אנחנו לא צריכים תיאוריה קוונטית כדי לסכם את עיקרי המבנה האטומי. כל האטומים מורכבים משני חלקים: לכל אטום יש גרעין טעון חיובי במרכזו, ומעטפת של אלקטרונים, מאסיבית הרבה פחות, טעונה שלילית, המקיפה את הגרעין.
באדיבות וויקפדיה
ממדי האטום זעירים ביותר. מימן הוא אטום הקטן ביותר עם קוטר של כ- 10-11 × 5.3 מטרים. ניתן לכנס כעשרה מיליון אטומי מימן על ראש הסיכה! הגרעין של אטום מימן מורכב מחלקיק בודד חיובי אחד הקרוי פרוטון. לאטומים כבדים יש סוג שני של חלקיקים גרעיניים הנקראים נויטרונים ופרוטונים. הנויטרונים דומים במסתם לפרוטונים, אך נייטרליים מבחינה חשמלית. הפרוטון קטן פי 10,000 פעמים מהאטום עצמו. המסה של אטום מימן הוא 10-27 × 1.7 ק"ג. אפילו אבק הקטן ביותר מכיל טריליוני טריליונים של אטומים. מאחר שמסת האלקטרון קטנה כמעט פי 2000 ממסת הפרוטון, ניתן לומר שהגרעין נושא את רוב המסה של האטום. עם זאת, לאלקטרונים הזעירים יש מטען חשמלי שווה אבל הפוך מזה של הפרוטון המסיבי יותר. חישובים אלה מבוצעים בדיוק מפתיע בטבע, והחומר הנורמלי נותר נייטרלי מבחינה חשמלית.
מספר הפרוטונים בגרעין מגדיר את היסוד. אטום של מימן, שהוא היסוד הפשוט ביותר, יש פרוטון אחד בגרעין שלו ואלקטרוני יחיד. לאטום של הליום יש שני פרוטונים ושני נויטרונים בגרעין, ושני אלקטרונים המקיפים אותם. לכל יסוד אחר יש מספר שונה של פרוטונים בגרעין. הטבלה המחזורית היא אינה אלא רצף של אטומים עם מספר גדל והולך של פרוטונים. מספר הפרוטונים והאלקטרונים באטום ניטרלי תמיד שווה. אין כלל פשוט למספר הנייטרונים, אבל בכל מקרה נייטרונים משפיעים על משקל האטום, אך לא על התכונות הכימיות של היסוד.
האלקטרונים פועלים כמגן הגרעין. בתנאים רגילים, יומיומיים, האלקטרונים המסתובבים סביב הגרעין מונעים מגרעין האטום ליצור קשר עם הגרעין של אטום אחר. אם שני אטומים נתקלים זה בזה, רק בין נחילי אלקטרונים מתקיימת אינטראקציה. אם הגרעין של האטום ייוצג על ידי כדור טניס הנמצא במרכז איצטדיון כדורגל, האלקטרונים יהיו חלקיקים זעירים מסתחררים ביציאים של האיצטדיון. האטומים השכנים, במצב מוצק, יהיו כדורי טניס אחרים במרחק של כמה מאות מטרים משם, כל אחד מהם עם נחילי האלקטרונים שלו. אנלוגיה זו נכונה אפילו עבור חומר צפוף כמו עופרת או זהב. מוצקותם של חפצים יומיומיים היא אשליה עקב כוח חשמלי הקיים בתוך אטומים. הריקנות של החומר הנורמלי היא אחת ההשלכות המדהימות של התיאוריה האטומית!
תיאוריה אטומית קובעת כי היסודות הם מבנים ראשוניים וכי לא ניתן לשנות יסוד אחד ליסוד שני באמצעים כימיים. מה מונע מאיתנו רק להוסיף או לחסר פרוטון מן הגרעין, כדי ליצור יסוד אחר? מתברר כוח מיוחד בתוך הגרעין פועל כדי לשמור על קשר הדוק בין הפרוטונים. דחייה חשמלית בין שני גרעינים טעונים במטען חיובי מונעת מהם להתמזג. גרעינים אטומיים יכולים להתמזג או להבקע לגרעינים קלים יותר בתנאי טמפרטורה ולחץ קיצוניים. אבל בעולם היומיומי, יסוד אינו משתנה לעולם. אתה יכול לחשוב על הגרעין האטומי כמבצר קטן: שום חלקיק לא יכול לעזוב ואף אחד לא יכול להיכנס אליו.

באדיבות וויקיפדיה.
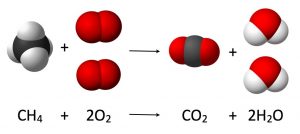
מה עם צורות מורכבות יותר של החומר? שלא כמו הגרעינים האטומיים, האלקטרונים נוטים להתקבץ בלהקות. הם נעים בקלות מאטום אחד למשנהו. מולקולות נוצרות כאשר אטומים חולקים את האלקטרונים שלהם. אם נחשיב את היסודות כאבני הבניין בעלי גודל ומסה שונים, אז מולקולות הן קבוצות של אטומים המחוברים על ידי האלקטרונים שלהם. מולקולות מסוימות מורכבות שניים או שלושה אטומים: מים (H2O), פחמן דו-חמצני (CO2), חנקן (N2). מולקולות אורגניות מורכבות ממאות אטומים. אם נעקוב אחר אנלוגיית הבניין, ישנם כ -110 יסודות שונים או אבני בניין בגודל שונה. כ -90 מהם קיימים בטבע, השאר נוצרו במעבדה. מצד שני, אבני הבניין הללו עשויות להתחבר במגוון דרכים עצום. ישנם אלפי מולקולות הנוצרות באופן טבעי, ועשרות אלפים שנוצרו במעבדה.
תגובות כימיות מתרחשות כאשר אטומים או מולקולות מוותרות על או סופחות אלקטרונים. זכור כי הגרעינים המרכזיים לא נפגשים או מתנגשים בתגובה כימית. אלמנטים בעלי מסה שונה לגמרי יכולים להיות בעלי התנהגות כימית דומה אם יש להם מספר דומה של אלקטרונים בחלקים החיצוניים שלהם. אם אתה מסתכל על הטבלה המחזורית, תראה כי יסודות הנמצאים באותה עמודה אנכית, לעתים קרובות, מציגים תכונות כימיות דומות מאוד. תגובות כימיות מתרחשות סביבנו כל הזמן.
הדיון הזה על חלקיקים קטנים כל כך, שהם בלתי נראים, מעלה שאלה נוקבת. האם האטומים אמיתיים? או שמא הם רק רעיון תיאורטי שמדענים יצרו כדי להפיק תועלת בתיאור הטבע? יש שפע של ראיות עקיפות לקיומן של יחידות זעירות של החומר, ובשנים האחרונות יש לנו ראיות ישירות. אנחנו יכולים להשתמש באלקטרונים כדי ליצור תמונות יפות מאוד של החומר. אנחנו יכולים גם להשתמש בשדות חשמליים כדי לחוש את המיקום של אטומים בודדים. משמעת חדשה הנקראת ננוטכנולוגיה מתעוררת, שתסייע למהנדסים לייצר מכשירים מאטומים ומולקולות בודדים. אין לנו ספק – אטומים אמיתיים.
Author: Chris Impey

