טמפרטורה מאפשרת למדוד את האנרגיה הקינטית הממוצעת של מולקולות החומר – או את תנועתן המיקרוסקופית. לכמות האנרגיה או למידת התנועה בחומר יש השפעות משמעותיות על מבנה החומר. מה קובע האם החומר נמצא במצב מוצק, נוזל או גז?

באדיבות וויקיפדיה
להבנת הקשר בין צורות החומר ביקום לבין הטמפרטורה חשיבות מעשית רבה. למרות שהמודל שנציג מקטין במידת מה את השפעות הלחץ ומשתנים אחרים, הרי הוא שימושי מאוד בהבנת צורות החומר. בטמפרטורות נמוכות ביותר, אנו מוצאים כי החומר נמצא במצב "קפוא", הוא קיים כמוצק. במצב צבירה זה החלקיקים בקושי נעים ומודבקים זה לזה במבנה נוקשה. הדבר נכון, בין אם החומר מורכב מאטומים (לדוגמה, פחמן) או מולקולות (כמו זכוכית), או תרכובת כימית (כמו מלט). הקשרים נוצרים על ידי שיתוף אלקטרונים בין גרעינים. הגרעינים מורכבים מפרוטונים וניטרונים. למוצקים שתי צורות כלליות. הם יכולים להיות אמורפיים, כמו זכוכית או פלסטיק. לאטומים במוצקים אמורפיים אין תבנית ברורה אבל הם מעוותים במבנה קבוע. מוצקים יכולים גם להיות גבישיים, כמו חול או מלח. האטומים בחומר גבישי נמצאים בדפוסים החוזרים על עצמם שוב ושוב בחומר המוצק. לפעמים המבנים הרגילים ממשיכים לגדול לממדים גדולים הרבה יותר מאשר גודל האטום. עד כדי כך שניתן לראות גבישים של מלח בעזרת זכוכית מגדלת. רוב המסה של כדור הארץ, נמצאת במצב מוצק גבישי. הגבישים היוצרים סלעים הם דוגמא טובה לאטומים המחוברים יחד בדפוס סריגי.
רצוי לזכור שהטמפרטורה היא דרך למדידת קצב התנועות של אטומים. ככל שמהירותם הממוצעת גבוהה יותר, כך הטמפרטורה של החומר גבוהה יותר, ולהיפך. בטמפרטורה של האפס המוחלט, או 00K, החלקיקים האטומיים יהיו כמעט חסרי תנועה (פרט לשרידים זעירים שמנבאת התורה הקוואנטית). אטומים במוצק מוחזקים במקומם כך שהם אינם יכולים לנוע בחופשיות. אבל כאשר אנו מעלים את הטמפרטורה של מוצק, האטומים ירטטו במהירות הולכת וגדילה.
באדיבות וויקיפדיה
בטמפרטורת החדר, סביב 3000K, אטומים בחומר טיפוסי רוטטים במהירות של כ ½ קילומטר לשנייה. אנרגיה זו מאפשרת לרבים מן האטומים להשתחרר מן הסריג אליו היו צמודים בטמפרטורות נמוכות. כאשר תהליך זה מתרחש, חומרים רבים מותכים לנוזל. במצב נוזלי האטומים עדיין בקשר הדוק, אך שרשראות או קבוצות של אטומים עשויות לנוע זו לעומת זו והמבנה הסריגי נהרס. כך מקבל הנוזל את צורת המכל שבו הוא נתון. האוקיינוסים של כדור הארץ נמצאים במצב נוזלי.
בטמפרטורות סביב 400-6000 קלווין, מהירות תנועת האטומים מגיעה לכדי כמה קילומטרים לשנייה. שרשראות האטומים מתפרקות, ולאטומים יש די אנרגיה כדי לעזוב את פני הנוזל ולעבור למצב גזי. אטומים בודדים או מולקולות בגז נעים ללא קשר עם מולקולות אחרות. ישנם רווחים גדולים בין החלקיקים, ואינטראקציה מתרחשת לעתים רחוקות יחסית, באמצעות התנגשויות אלימות. הצפיפות של רוב המוצקים והנוזלים דומות; אך הצפיפות של גזים נמוכה בכמה סדרי גודל. האוויר שאנו נושמים נמצא במצב גזי.
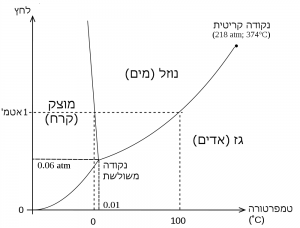
רוב החומרים משנים מצב צבירה ממוצק לנוזל או מנוזל לגז בטמפרטורות שונות מאוד. המעברים תלויים בקשרים הכימיים שבין מרכיבי החומר. בטמפרטורת החדר, רק האטומים או המולקולות הקלים ביותר יכולים להיות במצב גזי. מולקולות כבדות או מורכבות נמצאות תמיד במצב נוזלי או מוצק. מצב הצבירה של אטומים או מולקולות תלוי רק בכמות אנרגית החום שהם מכילים. כאשר מעלים את הטמפרטורה של מוצק כמו ברזל, ניתן להתיך אותו (ב- 0K1813) ולאחר מכן אפילו להביאו לכדי רתיחה כך שיהפוך לגז (ב- 30330K). מצד שני, אם נוריד את הטמפרטורה של גז, ניתן להפוך אותו לנוזל ואפילו למוצק. חנקן גזי באוויר שאתם נושמים, הופך נוזל ב- 770K (או -1960C- ) ומתמצק בטמפרטורה נמוכה עוד יותר 540K (או – -2190C ). רוב היקום נמצא בטמפרטורות הרבה יותר גבוהות או הרבה יותר נמוכות ממה שאנחנו רגילים.

קרור החומר מוביל למעבר מגז לנוזל ולמוצק. החימום מוביל ממצב מוצק למצב נוזלי גזי ואפילו פלזמה.
באדיבות וויקיפדיה
באנלוגיה למוצקים, נוזלים, וגזים ניתן לדמיין אנשים באולם התעמלות. אם אנשים רבים עומדים כולם יחד במקומם ועושים תרגילים, הם דומים לאטומים במצב מוצק, הם רוטטים אבל לא זזים ממקומם. אם האנשים מסודרים בשורות, הם דומים לאטומים בגביש סלעי, מסודרים בדגם סריג סימטרי. אם האנשים מתפזרים באקראי כדי לבצע את התרגילים שלהם, הם דומים לאטומים במוצק אמורפי, כמו זכוכית. עכשיו דמיינו קהל של אנשים היוצאים מפינת חדר כושר לאחר משחק, והם זורמים תוך נגיעה זה בזה במהלך היציאה. התנהגותם דומה התנהגות של נוזל. כדי לדמיין גז, חשבו על כמה אנשים מכוסי עיניים המפוזרים על באולם התעמלות. רוב הזמן הם עשויים לנוע בקווים ישרים, אבל לפעמים אנשים מתנגשים או מסתובבים בכיוונים שונים. התנהגות זו דומה לתנועת מולקולות גז, הנעות במרחקים גדולים זו מזו (בהשוואה לגודל של מולקולה בודדת), אך מדי פעם פוגעת מולקולה אחת במולקולה אחרת.
כל צורות החומר בכדור הארץ – מוצק, נוזלי וגז – קרירים יותר מהחומר בשמש או ברוב הכוכבים. אם נוסיף לחמם גז תגדל מהירות התנועה של האטומים. הם יפגעו חזק יותר ויותר זה בזה. בטמפרטורה של כמה אלפי קלווין, אטומים פגעו זה בזה בכוח כה רב עד שהאלקטרונים הקשרים לאטומים המרכיבים אותם משתחררים מסלולם סביב הגרעין. על פני השטח של השמש, למשל הטמפרטורה מגיעה בקרוב ל- 60000K. גרעיני מימן רבים בטמפרטורה זו איבדו את האלקטרונים שלהם, והם נעים במהירויות של כ- 10 ק"מ לשנייה או פי 20 מהר יותר מאשר את מולקולות האוויר שאנו נושמים. חומר במצב גזי שבו האלקטרונים עוזבים את גרעין האטום הינו גז מיונן, או פלזמה.
בליבות כוכבים החומר במצב גזי מחומם לטמפרטורות גבוהות מאוד. בניסוי המפורסם של ארנסט רתרפורד, חלקיקי אלפא, הטעונים במטען חיובי, נרתעו מגרעיני זהב הטעונים חיובית, בשל הכוח החשמלי. הכוח החשמלי מונע, בדרך כלל, מגרעיני האטום להגיע קרוב מדי זה לזה. אבל בשל הלחץ העצום והטמפרטורות הגבוהות בליבת הכוכב, גרעיני אטומיים יכולים להתנגש זה בזה בעוצמה רבה ולהיצמד אחד לשני בהשפעת הכוח הגרעיני החזק. גז בטמפרטורה של מיליוני קלווין יכול לשנות את מבנה היסודות מהם הוא מורכב, ולהפיק כמויות אנרגיה אדירות. זהו מקור האור של השמש.
Author: Chris Impey

