כאשר אלקטרון עובר לרמת אנרגיה נמוכה יותר, הוא פולט אנרגיה באמצעות פוטון. האנרגיה של הפוטון שווה להבדל בין רמת האנרגיה הגבוהה לבין זו שמתחתיה. אלקטרונים באטום יכולים לבצע רק שינויים מסוימים ברמות האנרגיה. לדוגמה, אם האלקטרון מתחיל ברמה 3, הוא יכול לרדת רק לרמה 2 או 1. אטומים יכולים לפלוט רק פוטונים בעלי אנרגיה המתאימה להבדלים שבין רמות האנרגיה. כתוצאה מכך, כל יסוד יכול לפלוט רק אורכי גל מסוימים. דוגמה אסטרונומית מוכרת היא הקרינה הנפלטת מגז מימן המכיל אטומים ניטרליים, שנמצאים ברמות אנרגיה שונות. קווי פליטה נובעים מהפוטונים הנפלטים בעת המעבר של האלקטרונים מרמת אנרגיה גבוהה לנמוכה יותר, מופיעים בספקטרום הגז כקווים או כפס צבע צר.
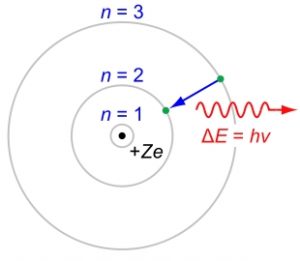
באדיבות וויקיפדיה
קווי פליטה ספקטרלית שימושיים במיוחד באסטרונומיה. לכל יסוד יש מספר פרוטונים ייחודי בגרעין ומספר אלקטרונים דומה המקיפים את הגרעין. כלומר, לכל אטום יש קבוצה ייחודית של רמות אנרגיה והאלקטרונים המדלגים ביניהן יוצרים קבוצה אופיינית של אורכי גל, המיוצגים על ידי קווי פליטה. ניתן להתאים קבוצה של קווי פליטה ליסוד מסוים ולהסיק כי אטומים של היסוד הזה נמצאים בגרם שמים מרוחק. אם יש יותר מיסוד אחד, דפוס קווי הפליטה מורכב יותר, מופעים בספקטרום יותר פסים, אבל העיקרון זהה. ניתן להסיק מהו הרכב גרם-השמים, גם מבלי להגיע אליו. לעומת זאת, הספקטרום הרציף של קרינת החום מספק מידע רק מידע על הטמפרטורה של גרם-השמים. באותה טמפרטורה, גוש ברזל או מוט פחמן או ענן של מימן פולטים אותה קרינת חום. לכן, קווים ספקטרליים נושאים הרבה יותר מידע אם אנחנו רוצים לקבוע את ההרכב הכימי של גרם שמים מרוחק.
אם האלקטרונים באטום נמצאים ברמת האנרגיה הנמוכה ביותר, האטום לא יכול ליצור קווי פליטה. הסיבה לכך היא שהאלקטרונים לא יכול לרדת לרמת אנרגיה נמוכה יותר. אטום שבו כל האלקטרונים נמצאים ברמת האנרגיה הנמוכה ביותר נמצא במצב היסוד שלו. אטום שבו אלקטרון אחד או יותר נמצאים ברמות האנרגיה גבוהות יותר מאשר הרמות הנמוכות ביותר, נמצא במצב מעורר. משך השהיה של אלקטרון ברמות מעוררות קצר מאד, רק שבריר שנייה, ומיד האלקטרונים דועכים לרמת אנרגיה נמוכה יותר – הם מנסים להגיע לשיווי משקל. אטומים בדרך כלל צריכים לספוג אנרגיה כדי ליצור ולשמור על מצבים מעוררים. תופעה זו מתרחשת בשתי דרכים. ראשונה, קרינה הפוגעת בגז ומוסיפה לו אנרגיה, וכך גורמת לאלקטרונים לעלות לרמות אנרגיה גבוהות. שנייה, בגז חם, אנרגיה נוספת לאטום בעקבות התנגשויות עם אטומים או מולקולות של הגז עצמו. חימום גז בנפח מסוים מגביר את מהירות האטומים וכך מגביר את ההסתברות שהם יתנגשו זה בזה.
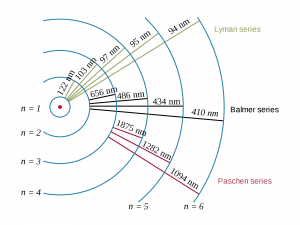
באדיבות וויקיפדיה
היכן בספקטרום האלקטרומגנטי נחפש קווי פליטה מאטומים? נבחן את המימן, היסוד הפשוט ביותר. האנרגיה הדרושה אלקטרון לעזוב את מצב היסוד ולהשתחרר מהאטום היא כמות האנרגיה הגדולה ביותר שיכולה ליצור קו ספקטרלי. לכן, מרווח אנרגיה זה מתאים לגל הקצר ביותר שאטום המימן פולט. אורך גל זה הוא כ- 90 ננומטר נמצא בתחום האולטרה סגול, הוא ארוך מכדי שעינינו יראו אותו. מעברי אלקטרונים אחרים במימן הם בעלי הפרשי אנרגיה קטנים יותר, ולכן הם יוצרים קווים ספקטרליים בעלי אורך גל קצר יותר. ליסודות כבדים מהמימן יש רמות אנרגיה רבות יותר, כך שיש להם מעברים אפשריים רבים יותר, היוצרים מערך סמיך וצפוף של קווי פליטה. הקווים הספקטראליים של היסודות הנפוצים ביותר בחלל כמו: פחמן, חנקן, חמצן וצורן, נמצאים באותו תחום של הספקטרום האלקטרומגנטי. רוב קווי פליטה שאנו מנתחים נמצאים בתחום שבין גל באורך 100 ננומטר ועד לגל באורך 1000 ננומטר (או בין 0.1 מיקרון ל- 1 מיקרון). תחום זה כולל גם את התחום הנראה, האולטרה סגול ואינפרה אדום.
מולקולות הן קבוצה של אטומים שיכולים לחלוק את האלקטרונים שלהם. לכן, מבנה רמות האנרגיה של האלקטרונים במולקולה מורכב יותר מאשר באטום. האלקטרון יכול לנוע סביב שני גרעינים או יותר. כתוצאה מכך, מבנה קו הפליטה של מולקולה יכול להיות מורכב. לדוגמה, בגז המכיל מולקולות מים (H2O) יש קווי פליטה רבים יותר מאשר גז המכיל רק אטומי H ו- O נפרדים. למולקולה יש דרכים שונות להגיב על הפרעה חיצונית, לבד משינוי מיקום האלקטרונים בין רמות האנרגיה שלה. לדוגמה, המולקולה עשויה לרטוט, בדומה לשני כדורים המקושרים בקפיץ, או שהיא עשויה להסתובב. כתוצאה מכך, רמות האנרגיה של מולקולה הן רבות מאד, וקווי הפליטה המתקבלים מתמזגים יחד ונוצרת תבנית פס פליטה. שאר הסיפור דומה, מולקולה נתונה (כגון H2O) יכולה לייצר רק פסי פליטה מסוימים, כך ניתן לזהות את המולקולה במקור מרוחק.
באדיבות astropidia
על מנת שאטומים ומולקולות יצרו קווי פליטה ברורים, הם חייבים להיות מנותקים זה מזה, כמו בגזים. אם האטומים מקושרים יחדיו, הם היו יוצרים מולקולות. כאשר המולקולות מקושרות הן יוצרות מוצק או נוזל. ברוב החומרים המוצקים או הנוזליים, מבנה רמות האנרגיה של האלקטרונים כה מורכב שמתקבלים רק פסי פליטה ולא קווים נפרדים. לכן, קשה להבחין במבנה פסי הפליטה של מוצקים ונוזלים. רוב קווי פליטה נוצרים בגזים.
היכן נחפש בספקטרום האלקטרומגנטי פסי פליטה ממולקולות? כמה פסים ספקטרליים של מולקולות נמצאים בספקטרום הנראה. עם זאת, למולקולות יש צורות המאפשרות להם לרטוט ולהתנדנד בדרכים רבות ושונות. רוב המצבים האלה מכילים פחות אנרגיה מאשר מעברי אלקטרון באטום, כך שהתבניות הספקטרליות הללו נמצאות בדרך כלל באורכי גל ארוכים יותר. רבים מן תבניות האנרגיה החשובות של מולקולות נמצאות בתחום אינפרה אדום או אפילו בתחום המיקרוגל של הספקטרום האלקטרומגנטי.
Author: Chris Impey

